プレスリリース
報道関係各位
ノバルティス ファーマ株式会社
ノバルティス ファーマ株式会社(本社:東京都港区、代表取締役社長:ジョンポール・プリシーノ)(以下「ノバルティス ファーマ」)は、本日、「プルヴィクト®静注」(一般名:ルテチウムビピボチドテトラキセタン(177Lu)、以下「プルヴィクト」)について、前立腺特異的膜抗原(PSMA)陽性の遠隔転移を有する去勢抵抗性前立腺がん(以下、mCRPC)に対する承認を取得しましたので、お知らせします。
プルヴィクトは、標的化合物(リガンド)と治療用放射性核種(放射性同位元素 ルテチウム-177)を組み合わせた薬物複合体で、PSMA陽性mCRPCに対して本邦で初めて承認された放射性医薬品です。
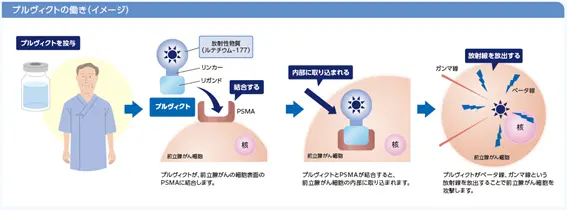
図1:「プルヴィクトⓇ静注による治療を受ける患者さんとご家族の方へ」P10
また、プルヴィクトは、治療前に対象となる前立腺がんのPSMA陽性病変を適切な画像診断により確認することが必須なことから、PSMA陽性病変を検出するための診断キット 「ロカメッツ® キット」(一般名:ゴゼトチド、以下「ロカメッツ」)、ならびに 「ガリアファーム® 68Ge/68Gaジェネレータ」(一般名:ガリウム(68Ga)ジェネレータ、以下「ガリアファーム」※)の承認も同日に取得し、これにより、PSMA陽性前立腺がんを対象としたセラノスティクス(治療と画像診断を融合した医療技術)を提供できることとなりました。
※ガリアファームは、Eckert & Ziegler Radiopharma GmbH社の製品で、ノバルティス ファーマは選任外国製造医薬品等製造販売業者として国内の販売を行います。
前立腺がんは、我が国の男性において最も罹患数が多いがんであり、毎年新たに約9.5 万⼈が前⽴腺がんと診断されています1。また、前⽴腺がんによる死亡は年間約1.3万⼈にも上り、今後⾼齢化の進展に伴いさらに増えると予想されます2。この中でも、mCRPC(転移性去勢抵抗性前立腺がん)は、ホルモン療法がもはや効果を示さず進行した前立腺がんです。国内のmCRPCの年間新規患者数は推計約1万人以上とされています3。mCRPCにおいては、化学療法にも抵抗性がある、あるいは適応できない患者さんもおり、生存率の向上と生活の質(QOL)の維持を目指した有効な治療選択肢が長らく求められてきました。プルヴィクトは、こうしたアンメットメディカルニーズに応える国内初の放射性リガンド療法(RLT)として期待されています。
プルヴィクトは、mCRPCを含む前立腺がんで高発現するPSMAに対して親和結合性を示すビピボチドテトラキセタンを177Lu(ルテチウムの放射性同位体)で標識した放射性医薬品です。PSMAに結合し、腫瘍細胞に取り込まれることにより腫瘍増殖抑制作用を発揮します4,5。
今回の承認について、ノバルティス ファーマの代表取締役社長であるジョンポール・プリシーノは、次のように述べています。「ノバルティスは、進行がん患者に対してRLTを用いた革新的な治療を提供することを目指しています。 RLTは、病気を認識して治療する精密な核医学の一種です。この治療をより多くの患者さんに提供することで、私たちが掲げる企業パーパス“Reimagine Medicine ~医薬の未来を描く~” の実現を目指します。 この目標をさらに推進するため、ノバルティスは篠山工場に1億ドルを投資し、国内でRLTを製造可能な施設の建設を進めています。この投資は、安定した供給体制の確立と製造能力の強化を目的としており、2026年度の稼働開始を目指しています。日本の患者さんに迅速かつ確実に治療を届けるための体制づくりに取り組んでまいります」。
プルヴィクトについて
プルヴィクトは、PSMA標的リガンドとして開発されたビピボチドテトラキセタン6にキレート剤のDOTA(1,4,7,10-Tetraazacyclododecane-tetraacetic acid)を結合させ、ルテチウムの放射性同位体177Luで標識した放射性医薬品です。177Luは半減期が6.647日のベータ線放出核種であり、ベータ線が腫瘍細胞に照射されDNA損傷を引き起こすことで細胞増殖抑制作用を示すと考えられます。周辺の正常組織への傷害が抑えられ、腫瘍への効率的な放射線照射が可能です。日本では、PSMA陽性mCRPC患者さんのうち、1剤以上の新規ARSI(アンドロゲン受容体経路阻害剤)及び1又は2剤のタキサン系悪性腫瘍剤による治療歴のある患者さん、1剤のARSIによる治療歴があり、タキサン系抗悪性腫瘍剤による治療歴のない患者さんを対象とした国内第Ⅱ相試験において有効性及び安全性等が評価され7、「PSMA陽性の遠隔転移を有する去勢抵抗性前立腺癌」を効能又は効果として承認を取得しました。
米国FDAや欧州EMAでは、ARSI及びタキサン系薬剤既治療のPSMA陽性の転移性去勢抵抗性前立腺がん(mCRPC)の治療薬として承認されています。また、米国FDAは、プルヴィクトの適応を、ARSIによる治療歴があり、化学療法の延期が適切と考えられるPSMA陽性mCRPC患者にも拡大しました。これにより、対象患者数が約3倍に拡大すると見込まれています8。
セラノスティクスについて
セラノスティクスは、治療と画像診断を融合させた新たな医療技術です。診断目的の放射線同位元素に変更することで、診断目的としても応用できます。診断用放射性リガンドで標的病変を可視化し、治療の適応判定をした上で、同じ標的に結合するリガンドを用いた治療用放射性リガンドで治療を行うことが可能です。このように1つの技術で「治療」 と 「診断」 の両方を行えることを、Therapeutics(治療)とDiagnostics(診断)を融合した造語「Theranostics(セラノスティクス)」と呼ばれています。
ロカメッツについて
ロカメッツは、放射性医薬品注射剤の診断キットであり、PSMA標的療法の前立腺癌患者への適応判定を補助します。放射性標識を付けた後、この造影剤は、陽電子放出断層撮影(PET)スキャンにより、mCRPCの成人患者のPSMA陽性病変を特定するために使用できます。ガリウム68標識ロカメッツは、PSMAバイオマーカーを発現している腫瘍病変を特定し、腫瘍が体内で転移している可能性のある場所(軟部組織、リンパ節、または骨など)を特定して、プルヴィクトによる標的治療に適した患者を特定できます。PSMAは前立腺がん患者の80%以上で高度に発現しているため、転移性前立腺がんの進行を評価するための重要な表現型バイオマーカーになっています。
ガリアファームについて
ガリアファームは、68Geを親核種とし、塩酸溶液を用いて、有効成分ガリウム(68Ga)を含む塩化ガリウム(68Ga)溶液を溶出させるために必要な装置及び不必要な被曝を避けるための十分な遮蔽装置を合わせたジェネレータ剤で、「陽電子放出断層撮影(PET)イメージングのために承認された被標識用製剤のガリウム(68Ga)標識」であり、溶出された塩化ガリウム(68Ga)溶液を用いて被標識用製剤を68Ga標識し、68Gaから放出される放射線(ガンマ線)によりPET検査の実施を可能にします。本剤は、PSMA標的療法の適応となる前立腺癌患者の選択に用いるロカメッツのガリウム(68Ga)標識に必要であり、国内では既存の代替薬は存在しません。
今回の承認について
この度の承認は、海外第III相試験A12301/VISION試験、B12302/PSMAfore試験ならびに日本人の進行性PSMA陽性mCRPC患者さんを対象に、プルヴィクトの有効性及び安全性を評価した国内第Ⅱ相試験A11201試験のデータに基づくものです。
海外第Ⅲ相A12301/VISION試験は、1剤以上のARSI及び1又は2剤のタキサン系抗悪性腫瘍剤による治療歴のあるPSMA陽性のmCRPC患者さんを対象に、プルヴィクトと最良の支持療法/標準療法(BSC/BSoC)との併用投与の有効性及び安全性をBSC/BSoCと比較しました。ARSI主要評価項目であるPCWG3基準*に基づく盲検下独立中央判定による画像診断上の無増悪生存期間(rPFS)及び全生存期間(OS)は、BSC/BSoC群と比較してプルヴィクト+BSC/BSoC群で統計学的に有意な延長を示しました9。
海外第Ⅲ相試験(B12302/PSMAfore試験)は、1剤のARSIによる治療歴があり、タキサン系抗悪性腫瘍剤による治療歴のない(タキサン系抗悪性腫瘍剤を含むレジメンを延期することが適切と考えられた)PSMA陽性のmCRPC患者さんを対象に、BSC併用下で、プルヴィクトと治験担当医師により選択された2剤目のARSIの有効性及び安全性を検討しました。主要評価項目であるPCWG3基準に基づく盲検下独立中央判定によるrPFSは ARSI群と比較してプルヴィクト群で有意な延長を示しました10。
安全性プロファイルは、海外第Ⅲ相試験(A12301/VISION試験、B12302/PSMAfore試験)及び国内第Ⅱ相試験(A11201試験)の結果、いずれも良好ですが、3試験の併合解析結果による重要な副作用として、貧血(22.4%)、血小板減少症(13.5%)、白血球減少症(12.3%)、リンパ球減少症(9.2%)、汎血球減少症(1.0%)、骨髄機能不全(0.1%)等の骨髄抑制、急性腎障害、腎不全、血中クレアチニン増加、血中尿素増加等の腎機能障害があらわれることがあります。その他の副作用には、口内乾燥疲労、悪心、 食欲減退、嘔吐、味覚不全、下痢、便秘などがみられました7,9,10。
* Prostate Cancer Clinical Trials Working Group 3;去勢抵抗性前立腺がん(CRPC)の臨床試験において、病勢進行を判定するための基準。具体的には、画像診断による病変の増大、骨スキャンによる新たな病変の出現などを評価する。
ノバルティスの放射性リガンド療法(RLT)について
ノバルティスは、進行がん患者に対する放射性リガンド療法(RLT)により、がん治療のあり方を刷新しつつあります。RLTは、標的放射線のエネルギーを利用し、進行がんに応用することで、標的腫瘍細胞に対し直接治療を届けるように設計されています。
ノバルティスでは、RLTの幅広いポートフォリオを検討しており、新しいアイソトープ、リガンド、併用療法を探求し、膵消化管神経内分泌腫瘍(GEP-NET)や前立腺がんに加え、乳がん、大腸がん、肺がん、および膵臓がんに取り組んでいます。ノバルティスは、RLTの生産拠点ネットワークにおいて、グローバルな専門知識、特化したサプライチェーン、製造能力を確立しています。RLTの需要拡大に対応するため、米国ニュージャージー州ミルバーン、スペイン・サラゴサ、イタリア・イブレアにおける生産能力の増強に加え、米国インディアナ州インディアナポリスに最新製造施設をオープンしました。また、RLTの使用拡大を下支えし、製造ネットワーク能力を高め、米国西海岸の患者さんへの薬剤供給を最適化するために、米国カリフォルニア州カールスバッドに米国で三番目となるRLT製造拠点を設立しています。
ノバルティス ファーマ株式会社について
ノバルティス ファーマ株式会社は、スイス・バーゼル市に本拠を置く革新的医薬品のグローバル製薬企業、ノバルティスの日本法人です。ノバルティス ファーマは、より充実した健やかな毎日のために、「医薬の未来を描く(Reimagining Medicine)」ことを追求しています。
詳細はホームページをご覧ください。https://www.novartis.co.jp
ノバルティス ファーマ株式会社のソーシャルメディアもご覧ください。Facebook LinkedIn YouTube Instagram
以上
参考文献
- 2022 年。国⽴がん研究センターがん情報サービス「がん統計」(厚⽣労働省⼈⼝動態統計)
- 2019 年。国⽴がん研究センターがん情報サービス「がん統計」(全国がん登録)
- 溝脇尚志、細野眞、上村博司、江藤正俊、大家基嗣、三宅秀明、池田公史、金ヶ崎彩子、櫻木俊輔、 老田有平、絹谷清剛: シミュレーションによる核医学治療の待機期間の変化予測と適切な治療提供体制の検討
- Benešová M, et al.: J Nucl Med. 2015; 56: 914-920.
- Fendler WP, et al.: J Nucl Med. 2017; 58: 1786-1792.
- Wright GL Jr, et al.: Urol Oncol.: 1995; 1(1): 18-28(PMID:21224086)
- 社内資料:国内第Ⅱ相試験(A11201試験)(2025年9月19日承認、CTD2.7.2-2.3.2.2, CTD2.7.2-1.2.2.2, CTD2.7.6-4.2.1)
- Novartis Pluvicto™ approved by FDA as first targeted radioligand therapy for treatment of progressive, PSMA positive metastatic castration-resistant prostate cancer
- 社内資料:海外第Ⅲ相試験(A12301/VISION試験)(2025年9月19日承認、CTD2.7.6-4.1.1)
- 社内資料:海外第Ⅲ相試験(B12302/PSMAfore試験)(2025年9月19日承認、CTD2.7.6-4.1.2)
<参考資料>
「プルヴィクト®静注」の製品概要
製品名: 「プルヴィクト®静注」
一般名:ルテチウムビピボチドテトラキセタン(177Lu)
効能又は効果**:PSMA陽性の遠隔転移を有する去勢抵抗性前立腺癌
用法及び用量**:通常、成人にはルテチウムビピボチドテトラキセタン(177Lu)として1 回7.4 GBqを6 週間間隔で最大6 回静脈内投与する。なお、患者の状態により適宜減量する。
承認取得日: 2025年9月19日
製造販売:ノバルティス ファーマ株式会社
<参考資料>
「ロカメッツ® キット」の製品概要
製品名: 「ロカメッツ® キット」
一般名:ゴゼトチド
効能又は効果**:PSMA標的療法の前立腺癌患者への適応判定の補助
用法及び用量**:通常、成人にはガリウム(68Ga)ゴゼトチドとして111~259MBqを静脈内投与し、投与50~100分後に陽電子放出断層撮影(PET)法により撮像を開始する。
承認取得日:2025年9月19日
製造販売:ノバルティス ファーマ株式会社
<参考資料>
「ガリアファーム® 68Ge/68Gaジェネレータ」の製品概要
製品名: 「ガリアファーム® 68Ge/68Gaジェネレータ」
一般名:ガリウム(68Ga)ジェネレータ
効能又は効果**:陽電子放出断層撮影(PET)イメージングのために承認された被標識用製剤のガリウム(68Ga)標識。
用法及び用量**:適量の溶出用0.1mol/L塩酸溶液により塩化ガリウム(68Ga)溶液の必要量を溶出し、担体分子のin vitro標識に用いる。
承認取得日: 2025年9月19日
製造販売:
外国製造医薬品等特例承認取得者 Eckert & Ziegler Radiopharma GmbH
選任外国製造医薬品等製造販売業者 ノバルティス ファーマ株式会社
** 「効能又は効果に関連する注意」、ならびに「用法及び用量に関連する注意」の詳細については、電子化された添付文書(電子添文)をご覧下さい。
印刷するには以下の印刷ボタンをクリックし、次のページで右クリックの上、メニューの「印刷」を選択してください。
また、この文章は印刷ページにも表示されます。